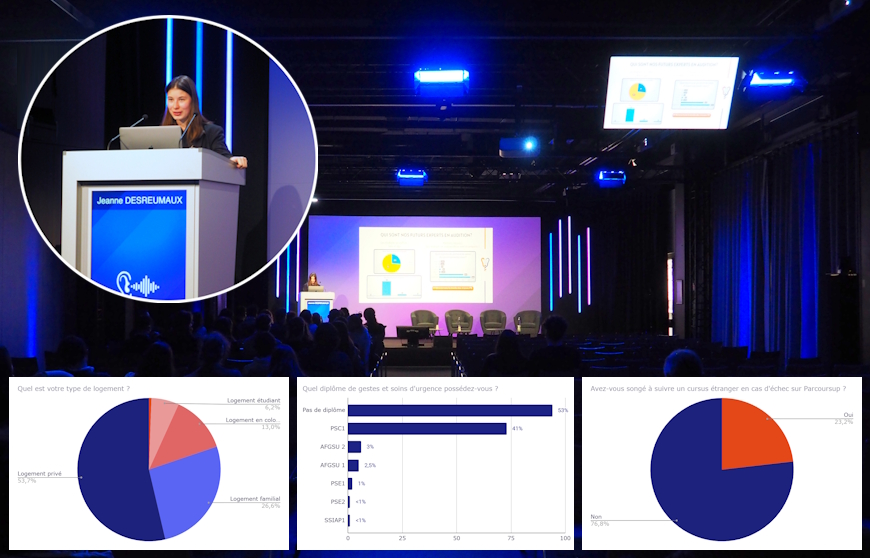
La journée de l’audition du Congrès de la SFORL a consacré une de ses tables rondes à l’évaluation et au financement des innovations dans notre secteur. Ces étapes impliquent un parcours normé et complexe, notamment pour l’obtention d’une prise en charge du dispositif médical par l’Assurance maladie.
Les innovations en audiologie, qu’il s’agisse d’une aide auditive ou d’un logiciel, sont généralement des dispositifs médicaux (DM). Avant d’être mis sur le marché, chaque fabricant doit démontrer leur efficacité, leur sécurité, rédiger la documentation technique et mettre en place un management de la qualité. Un organisme notifié délivrera alors le marquage CE. Ce n’est qu’à l’issue de ce processus qu’une prise en charge publique pourra être mise en œuvre, après de multiples étapes allant de l’évaluation de la HAS à une éventuelle régulation tarifaire (comme pour les aides auditives de classe I), a expliqué Armelle Graciet, directrice des affaires industrielles au Snitem. « Si vous développez une solution qui répond à un vrai besoin médical, qui a une vraie valeur ajoutée par rapport à ce qui existe déjà et si vous savez vous faire accompagner, alors vous trouverez votre marché », a-t-elle expliqué.
Simon Renner, chef de projet Mission du numérique en santé à la HAS, a de son côté rappelé le cadre législatif relatif aux dispositifs médicaux numériques (notamment ceux à visée thérapeutique) qui font l’objet d’un processus dédié prévu par la LFSS 2022. Dans tous les cas, ceux-ci doivent être évalués par la CNEDiMTS (Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé), qui donne, après diverses consultations, un avis sur la base duquel le ministère rendra sa décision de prendre en charge, ou pas, le dispositif en question. En ce qui concerne les DM numériques à usage professionnel (systèmes d’aide au dépistage et au diagnostic, ou d’aide à la décision médicale ou thérapeutique), des travaux sont en cours pour construire un cadre de confiance et favoriser leur intégration dans le système de santé. Pour l’heure, la HAS recense les usages et besoins des professionnels, en parallèle de l’analyse de la littérature. « Notre constat est qu’il existe un vrai besoin d’aide au choix et à la sélection des DMN à usage professionnel », a expliqué Simon Renner.
Les fonds d’investissement financent « à la tête du client »
L’Agence du numérique en santé, représentée sur cette table ronde par Elsa Creac’h (responsable de missions) mise de son côté sur l’expérimentation et la co-conception en conditions réelles pour la mise sur le marché d’innovations en santé numérique. C’est dans ce cadre qu’elle a lancé un appel à projets pour mettre en place 30 tiers-lieux d’expérimentations d’ici 2026. Toutes les structures de santé (sanitaire ou médico-sociale, publique ou privée, en ville ou en établissement) ainsi que les acteurs de l’innovation (intégrant dans leur gouvernance une structure de santé) peuvent candidater pour devenir un de ces tiers-lieux. Cette opération vise à tester une centaine de solutions, notamment celles favorisant la médecine 5P (préventive, prédictive, participative, personnalisée, pertinente).
Notons qu’en parallèle de ces parcours mis en place par l’Etat, les fabricants de dispositifs médicaux peuvent obtenir des financements dans le privé, via des fonds d’investissement. Dans ce cas, le « choix se fait à la tête du client », a déclaré sans faux semblant Catherine Boule, directrice de la société de capital-risque Karista, en mettant en avant l’importance de l’intuition et de l’expérience dans ce type de dossier. Le fonds évaluera ici l’équipe chargée de développer le dispositif. Il étudiera également les voies de financement possibles en l’absence de prise en charge par l’Assurance maladie.